Toxoplasmosis en Perros y Gatos
La Toxoplasmosis en Perros y Gatos
Etiología de la Toxoplasmosis en Perros y Gatos:
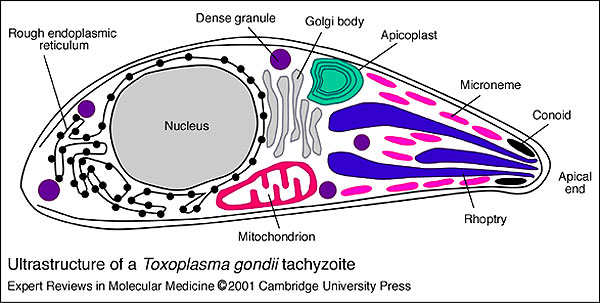
Toxoplasma gondii es un protozoo ubicuo de los animales de sangre caliente, donde la infección crónica es frecuente y la infección reciente raramente es bien diagnosticada. Se trata de un parásito intracelular obligado perteneciente al orden Coccidia y al Phyllum Apicomplexa.
La enfermedad se presenta en tres formas: el ooquiste que contiene esporozoítos, que vive y resiste a la intemperie, el taquizoíto, su forma proliferativa y el bradizoíto, que vive en los quistes tisulares. La multiplicación de los taquizoítos es siempre intracelular por endodiogonia dentro de una vacuola parasitófora de las células nucleadas. Llega a contener de 8 a 32 taquizoítos, antes que la célula muera y libere los parásitos que colonizarán nuevas células. Simultáneamente con el desarrollo de la inmunidad humoral y celular, los taquizoítos dejan de progresar y proliferan los quistes habitados por bradizoítos en los tejidos. Los bradizoítos son más pequeños, de multiplicación lenta y son la fuente de las reactivaciones y de la transmisión por consumo de carnes. Se han descrito tres tipos de linajes clonales. El clon tipo I es más común en casos de toxoplasmosis congénita humana y mayor virulencia en infecciones en ratones, el clon tipo II está identificado más comúnmente en humanos, en casos de SIDA y en casos congénitos, y el clon tipo III es el más veces aislado en animales1.
Epidemiología dela Toxoplasmosis en Perros y Gatos:
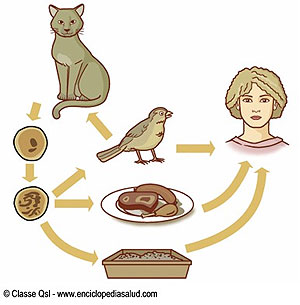
La enfermedad puede tener alguna de estas presentaciones: aguda sintomática, aguda asintomática, crónica y congénita. Sólo los miembros de la familia Felidae (gatos y otros felinos) son los huéspedes definitivos. Los demás huéspedes, así como el ser humano son huéspedes intermediarios en la cadena biológica del parásito.
La vida del parásito en el gato incluye un ciclo enteroepitelial con una división sexuada y otra asexuada intracelular. Una faz ezquizogónica y una gametogónica se desarrollan en todo el intestino delgado, pero se concentran especialmente en la extremidad de las vellosidades del íleo, terminan con la producción de los ooquistes. De esta manera, los felinos son los únicos con una fase sexuada. El período prepatente, en los gatos, es el comprendido entre la ingesta del parásito hasta la formación de ooquistes. Es variable, si comienza con la ingestión de un quiste tisular, el período prepatente es de 3 a 10 días; si ingirió taquizoítos es de 19 a 48 días y si ingirió ooquistes es de 21 a 48 días. Los gametocitos aparecen en el intestino delgado de 3 a 15 días después de la infección.
La infección en el hombre y en los animales ocurre, generalmente, por ingestión de quistes tisulares viables en carnes crudas o mal cocidas (en el caso de los gatos, por consumo de huéspedes secundarios como ratones y ratas que albergan quistes), o bien por ingestión de ooquistes infectivos eliminados con las heces de los felinos, a través del suelo y agua contaminados. Se ha descrito, asimismo, la incidencia de la toxoplasmosis en diversos animales salvajes de nuestro país, lo que indicaría que la enfermedad circula activamente en distintos hábitats2. Muchos gatos salvajes y domésticos pueden ser infectados por Toxoplasma gondii, sin embargo, la toxoplasmosis enfermedad es rara en esta especie3. La infección se produce en general a una temprana edad. La eliminación de ooquistes no es recurrente en aquellos gatos adultos con repetidas infecciones, sometidos a tratamientos con corticoides o infectados con el virus de la inmunodeficiencia felina.
La respuesta clínica del animal ante la infección por Toxoplasma gondii, está determinada por el estado inmune, tiempo de infección, la predisposición genética individual y la parte del cerebro afectada. Se han comunicado, en la Provincia de Buenos Aires y Capital Federal, seroprevalencias del 44% en gatos y del 28% en perros, entre los años 1997 y 2003, así como también del 60% en ambas especies entre 1988 y 19944, 5. En Brasil, 2006, se ha detectado una tasa de seropositivos entre los gatos de hasta un 84%. Por otra parte, la prevalencia del parásito en gallinas de campo puede ser considerada como un buen indicador de la prevalencia de ooquistes de Toxoplasma gondii en el medio ambiente, considerando que su infección proviene del contacto con el suelo. En nuestro país, se encontró hasta un 65% de prevalencia en gallinas, siendo el genotipo 3 el más frecuente entre los aislamientos.
Se demostró que el agua es una fuente de diseminación y en algunos casos de brotes.
Patogenia de la Toxoplasmosis en Perros y Gatos:
Toxoplasma gondii entre los animales tiene afinidad selectiva por el tejido muscular y cerebral, con capacidad para persistir crónicamente desde una edad temprana (Nelson Couto, 1998). Hay que diferenciar en los tejidos la presencia de la toxoplasmosis enfermedad, de la mera presencia de quistes. El hallazgo anatomopatológico de la toxoplasmosis enfermedad son granulomas y necrosis tisular. Toxoplasma gondii aparenta ser inofensivo en su forma de quistes y pseudos-quistes, pero la ruptura de éstos los libera y ocasiona invasión de tejidos vecinos con la consecuente reacción del organismo y generación de focos de infección activa. Los quistes llegan a contener 3.000 esporozoítos, pueden estar en estado silente durante años, y ser activados por distintos factores no totalmente conocidos e inmunodepresión. Las paredes de los ooquistes y de los quistes tisulares ingeridos por el huésped intermediario, posteriormente sufren la acción de los jugos digestivos y liberan los parásitos que se transforman en taquizoítos. Estos se diseminan por vía sanguínea y linfática y, así, pueden llegar a los tejidos del organismo. Los taquizoítos son la forma de multiplicación rápida, responsables de la mayor parte de la acción citopática y daño tisular. En los pequeños carnívoros, en condiciones normales y después de la exposición a Toxoplasma gondii, viene la respuesta inmunológica humoral y celular. Aunque los anticuerpos y el complemento reducen la diseminación del microorganismo en su etapa de taquizoíto, tienen muy poca actividad en las formas intracelulares y las formas quísticas (Tizard I, 2004). En aquellos animales inmunodeprimidos (i.e. gatos infectados con Panleucopenia felina o con leucemia) la ruptura de los quistes resulta en la reactivación de la enfermedad, incluyendo encefalitis o toxoplasmosis diseminada.
En el perro, como en muchos otros mamíferos, Toxoplasma gondii es causa de abortos y mortandad perinatal, con hallazgo simultáneo de títulos serológicos positivos (Feldman & Nelson, 1996). El organismo puede cruzar la placenta e infectar el feto.
Toxoplasma gondii se localiza, en las fibras miocárdicas de varias especies animales, y mientras que los quistes tisulares se mantienen íntegros, no provoca ninguna reacción. En cambio, cuando éstos se rompen, en el perro se origina una miocarditis focalizada linfohistiocitaria con hialinización parcial de las fibras, hemorragia y lesiones necrótico-distróficas con calcificación. Los quistes y los taquizoítos libres se observan en los márgenes de los gránulos necróticos entre las fibras miocárdicas.
Las alteraciones provocadas por Toxoplasma gondii en el SNC tienen diferente gravedad según la localización y la extensión del área infectada, y son normalmente del tipo y de la intensidad de consecuentes procesos regresivos y flogísticos (Pfohl & Dewey, 2005). Neuropatológicamente, las células gliales, especialmente los astrositos, son selectivamente afectados. En el perro, se pueden observar, microscópicamente, focos hemorrágicos o de necrosis del tejido cerebral. En el perro y en otras especies animales, El SNC puede presentarse, también, macroscópicamente normal. Histopatológicamente, los quistes parasitarios están presentes en estado quiescente, inmersos en un tejido nervioso del todo normal, o bien se los encuentra en cuadros de flogosis no purulentas en las meninges, con prevalencia de elementos linfocitarios e histiocitarios, y con un exudado que puede variar desde el seroso hasta el hemorrágico. En cambio, en el tejido nervioso, predomina la necrosis focalizada o diseminada. También los vasos arteriales y venosos del SNC presentan necrosis parietal y son circundados de manguitos inflamatorios, desde serofibrinosos a hemorrágicos. La microglía prolifera y, frecuentemente, se forman pequeños granulomas, que se asocian a la proliferación de capilares sanguíneos (Pfohl & Dewey, 2005).
En los casos de hepatitis y encefalitis por toxoplasmosis, la histopatología arroja la presencia de taquizoítos en ambos órganos, y también de gametas y ooquistes en las células epiteliales hepáticas (Dubey et al., 1995).
Las lesiones del pulmón manchado con áreas de creciente densidad y edema, son típicas de los gatos con la infección aguda, conjuntamente con hepatomegalia con pequeños focos oscuros, endocarditis y miocarditis.
Las lesiones oculares, frecuentemente diagnosticadas en gatos, son la retinitis y la uveítis anterior granulomatosa, mientras que en el perro, los trastornos oculares de gravedad más comunes son la retinocoroiditis, la uveítis anterior y el desprendimiento de retina (Gelatt, 1999). La patogenia de la toxoplasmosis ocular podría ser diferente en humanos y gatos, y la uveítis anterior representaría un tipo de inflamación inmunomediada (Davidson, 2000).
Signos clínicos de la Toxoplasmosis en Perros y Gatos:
 La toxoplasmosis clínica es comúnmente reportada en gatos, siendo la fiebre persistente, la ictericia terminal, la leucopenia, los desórdenes oculares, pulmonares, hepáticos, neurológicos, gastrointestinales y musculares, los hallazgos más consistentes. Los gatos jóvenes son más susceptibles a la forma aguda de la enfermedad, y observan períodos extendidos de elevadas temperaturas refractarios a la medicación, acompañados de letargia, anorexia y disnea. Los síntomas pueden semejar, ocasionalmente, un distress respiratorio (sin tos) por la progresiva bronconeumonía, una severa enteritis, u ocasionalmente, una miocarditis, pancreatitis, hepatitis o linfoadenitis abdominal (Nelson Couto, 1998). A veces, la toxoplasmosis digestiva en los gatos ascíticos está asociada a la Peritonitis Infecciosa Felina (PIF) (Toomey et al., 1995). En nuestro medio, se han observado los síntomas neurológicos y oculares, como los más frecuentes entre gatos y perros examinados en la clínica diaria (Gury Dohmen, 1995). La miocarditis es frecuentemente identificada en el examen post-mortem, aunque puede ser detectada clínicamente por ecocardiografía acompañada de un aumento en los títulos IgG e IgM anti-Toxoplasma. Se han observado abortos en gatas y, si la infección es sistémica, puede ser confundida con la Panleucopenia Felina o, simplemente, con una obstrucción intestinal, estando los síntomas en función del órgano afectado. En caso de un compromiso masivo, la muerte puede ocurrir en pocos días. Los síntomas de toxoplasmosis congénita corresponden a los daños infringidos por el parásito durante el desarrollo fetal. Incluyen hidrocefalia o microcefalia, calcificaciones intracraniales, sordera, convulsiones, parálisis muscular, daño retinal y retardo mental, la mayoría desarrollados en distintos momentos del crecimiento. También puede alterar el comportamiento y la función neurotransmisora. Sin embargo, los síntomas nerviosos en el gato no son comunes, incluso en aquellos individuos con la infección cerebral, y se resumen en ataxia, pérdida de la visión, incoordinación, temblores, agitación de cabeza y desplazamientos en círculo (Fulley Torrey & Yolken, 2003). Los gatos mayores de edad son propensos a formas crónicas, con síntomas semejantes a los de un linfosarcoma, acompañados de síntomas nerviosos como las convulsiones, debido a los granulomas toxoplásmicos en el cerebro (Pfohl & Dewey, 2005). Toxoplasma gondii ha demostrado ser causante de la pérdida de memoria y retardar el aprendizaje en ratones y ratas (Freyre A et al., 2006). Estos cambios de comportamiento conducen a los roedores a la disminución de su aversión por el olor a los gatos y aumentan la probabilidad de que sean cazados y comidos por estos últimos. Esto permite al Toxoplasma gondii completar su ciclo vital: todo un ejemplo de “manipulación evolutiva del hospedador” por el parásito (Berdoy et al., 2000).
La toxoplasmosis clínica es comúnmente reportada en gatos, siendo la fiebre persistente, la ictericia terminal, la leucopenia, los desórdenes oculares, pulmonares, hepáticos, neurológicos, gastrointestinales y musculares, los hallazgos más consistentes. Los gatos jóvenes son más susceptibles a la forma aguda de la enfermedad, y observan períodos extendidos de elevadas temperaturas refractarios a la medicación, acompañados de letargia, anorexia y disnea. Los síntomas pueden semejar, ocasionalmente, un distress respiratorio (sin tos) por la progresiva bronconeumonía, una severa enteritis, u ocasionalmente, una miocarditis, pancreatitis, hepatitis o linfoadenitis abdominal (Nelson Couto, 1998). A veces, la toxoplasmosis digestiva en los gatos ascíticos está asociada a la Peritonitis Infecciosa Felina (PIF) (Toomey et al., 1995). En nuestro medio, se han observado los síntomas neurológicos y oculares, como los más frecuentes entre gatos y perros examinados en la clínica diaria (Gury Dohmen, 1995). La miocarditis es frecuentemente identificada en el examen post-mortem, aunque puede ser detectada clínicamente por ecocardiografía acompañada de un aumento en los títulos IgG e IgM anti-Toxoplasma. Se han observado abortos en gatas y, si la infección es sistémica, puede ser confundida con la Panleucopenia Felina o, simplemente, con una obstrucción intestinal, estando los síntomas en función del órgano afectado. En caso de un compromiso masivo, la muerte puede ocurrir en pocos días. Los síntomas de toxoplasmosis congénita corresponden a los daños infringidos por el parásito durante el desarrollo fetal. Incluyen hidrocefalia o microcefalia, calcificaciones intracraniales, sordera, convulsiones, parálisis muscular, daño retinal y retardo mental, la mayoría desarrollados en distintos momentos del crecimiento. También puede alterar el comportamiento y la función neurotransmisora. Sin embargo, los síntomas nerviosos en el gato no son comunes, incluso en aquellos individuos con la infección cerebral, y se resumen en ataxia, pérdida de la visión, incoordinación, temblores, agitación de cabeza y desplazamientos en círculo (Fulley Torrey & Yolken, 2003). Los gatos mayores de edad son propensos a formas crónicas, con síntomas semejantes a los de un linfosarcoma, acompañados de síntomas nerviosos como las convulsiones, debido a los granulomas toxoplásmicos en el cerebro (Pfohl & Dewey, 2005). Toxoplasma gondii ha demostrado ser causante de la pérdida de memoria y retardar el aprendizaje en ratones y ratas (Freyre A et al., 2006). Estos cambios de comportamiento conducen a los roedores a la disminución de su aversión por el olor a los gatos y aumentan la probabilidad de que sean cazados y comidos por estos últimos. Esto permite al Toxoplasma gondii completar su ciclo vital: todo un ejemplo de “manipulación evolutiva del hospedador” por el parásito (Berdoy et al., 2000).
Las lesiones oculares (corioretinitis y uveítis anterior) son una manifestación común de la toxoplasmosis generalizada en perros y gatos, siendo la iritis con una cámara anterior nubosa un buen indicio diagnóstico seguido de la pérdida de la visión (Davidson, 2000).
La reactivación de la toxoplasmosis latente es, usualmente, secundaria en los gatos tratados con ciclosporina que induce a inmunodepresión y la presencia de signos respiratorios o digestivos debería alertar a los veterinarios sobre la posibilidad de una toxoplasmosis clínica recurrente (Barrs et al., 2006; Last RD, 2004).
El cuadro clínico en el perro es, en general, complicado dado su carácter sub-clínico. Es común la confusión con casos atípicos de Distemper o neumonías, úlcera intestinal, granulomas o compromiso hepático degenerativo. Los cuadros agudos fatales se extienden por 3 meses. La polimiositis toxoplásmica es de ocurrencia en perros con registro de tratamiento con glucocorticoides por problemas de piel y cursa con una parálisis e hiperestesia generalizadas, mioglobinuria y elevación de las enzimas musculares (Greene et al., 1985).
Diagnóstico de la Toxoplasmosis en Perros y Gatos:
El diagnostico definitivo de toxoplasmosis en los animales vivos sólo puede lograrse por biopsia, aislamiento del organismo, o con títulos crecientes o altos de anticuerpos específicos. El diagnostico clínico de rutina se apoya en los síntomas compatibles confirmados con las pruebas serológicas7. Los gatos adultos raramente presentan síntomas clínicos de toxoplasmosis durante la primoinfección y la fase de eliminación de ooquistes.
Hay varias técnicas usadas para el diagnostico en perros y gatos. Las pruebas coprológicas para detectar ooquistes en materia fecal de gatos, son de poca importancia debido a la corta patencia (15 días).
En los gatos sanos, se recomienda el examen de heces para la búsqueda de ooquistes por técnicas de flotación aunque es poco gratificante, ya que la eliminación de los ooquistes es transitoria, y pasan fácilmente desapercibidos por su pequeño tamaño. La inoculación de ratones con material sospechoso es aceptable, pero la aparición de quistes en el cerebro del ratón requiere 40 días.
Toxoplasma gondii puede, ocasionalmente ser identificado en sedimentos teñidos de líquido cerebroespinal, saliva, exudados, o tejidos sospechosos obtenidos de punciones, biopsias y necropsias. La observación de quistes o taquizoítos en cerebro, pulmón, retina e hígado por medio de técnicas histopatológicas, es decisiva, máxime si se trabaja con técnicas inmunohistoquímicas específicas.
El diagnóstico diferencial de toxoplasmosis con respecto a otros desórdenes neurológicos, está basado en la historia y los signos clínicos del caso, más los resultados de estudios generales y específicos.
Las pruebas serológicas son las más empleadas. El Sabin-Feldman Dye-test y la inmunofluorescencia indirecta (IFAT) que requieren taquizoítos intactos, son más sensibles y específicos que la inhibición de la aglutinación (HAI) o el ELISA. En gatos sospechosos, se aconsejan las pruebas serológicas de IFAT, de microaglutinación directa (MAT) o ELISA para el rastreo de anticuerpos, IgG, IgA o IgM (Desmonts & Remington, 1980; Nishikawa et al., 2000).
 La IFAT establece convencionalmente la prevalencia de anticuerpos anti-Toxoplasma gondii IgG específicos en suero y humor acuoso de gatos, con un título mínimo positivo de 1:32 (Haddadzadeh et al., 2006; Meunier et al., 2006). La detección de IgG específicas también se realiza mediante aglutinación directa o HAI. Las IgG se elevan a las 2 a 4 semanas de la infección y persisten al menos por un año. No obstante, un solo titulo positivo de IgG no permite distinguir la infección activa de la crónica. Es necesario realizar, al menos, 2 determinaciones séricas de IgG en el término de 2 a 3 semanas. En caso que los títulos se eleven hasta 4 veces, se trataría de una infección activa. A veces, estos gatos muestran títulos de suero anti-Toxoplasma gondiiet al., 2005). mayores o iguales a 1:1204. Los títulos de los anticuerpos caen prácticamente a nivel mínimo al tiempo que la infección se hace crónica (6-10 meses post-infección). La seroprevalencia en los gatos, aumenta con la edad y es mayor en machos y en gatos domésticos de pelo corto, en comparación con las hembras y otras razas, según recientes estudios epidemiológicos en búsqueda de anticuerpos específicos IgG e IgM con la prueba de ELISA, que arrojó hasta un 43% de seropositividad con al menos una de las gammaglobulinas (Vollaire
La IFAT establece convencionalmente la prevalencia de anticuerpos anti-Toxoplasma gondii IgG específicos en suero y humor acuoso de gatos, con un título mínimo positivo de 1:32 (Haddadzadeh et al., 2006; Meunier et al., 2006). La detección de IgG específicas también se realiza mediante aglutinación directa o HAI. Las IgG se elevan a las 2 a 4 semanas de la infección y persisten al menos por un año. No obstante, un solo titulo positivo de IgG no permite distinguir la infección activa de la crónica. Es necesario realizar, al menos, 2 determinaciones séricas de IgG en el término de 2 a 3 semanas. En caso que los títulos se eleven hasta 4 veces, se trataría de una infección activa. A veces, estos gatos muestran títulos de suero anti-Toxoplasma gondiiet al., 2005). mayores o iguales a 1:1204. Los títulos de los anticuerpos caen prácticamente a nivel mínimo al tiempo que la infección se hace crónica (6-10 meses post-infección). La seroprevalencia en los gatos, aumenta con la edad y es mayor en machos y en gatos domésticos de pelo corto, en comparación con las hembras y otras razas, según recientes estudios epidemiológicos en búsqueda de anticuerpos específicos IgG e IgM con la prueba de ELISA, que arrojó hasta un 43% de seropositividad con al menos una de las gammaglobulinas (Vollaire
La seroprevalencia en los animales domésticos está en dependencia de las variaciones locales endémicas o no, de las prácticas de alimentación y, también, de la habilidad de los ooquistes por sobrevivir en diferentes climas.
Las IgM, detectadas por ELISA comerciales, se elevan al cabo de 1 a 2 semanas post-infección y persisten durante al menos 12 a 16 semanas (Cordero, 2002). Los títulos de IgM 1:64 o mayores sugieren una infección reciente. En cambio, un título prolongado de IgM, significaría una reactivación de una infección crónica o una respuesta retardada en la aparición de IgG causada por inmunodeficiencias. Las pruebas serológicas comunes no pueden predecir con exactitud qué gatos, al momento que sus anticuerpos son detectados en el suero, están eliminando ooquistes. Así, una pequeña proporción de gatos seropositivos podrían, todavía, estar eliminando ooquistes.
Por otro lado, un gato seronegativo podría estar sano, o bien, haber estado recientemente infectado y estar corrientemente eliminando ooquistes.
En perros, puede recurrirse, también, a la IFAT y al ELISA como pruebas serológicas específicas, siempre correlacionándolas con la presencia de signos clínicos. En nuestro medio, se estableció una alta correlación entre la serología positiva y la sintomatología (69% en gatos y 62% en perros)8.
Los estudios de diagnóstico diferencial deben descartar organismos como Neospora caninum y Hammondi hammondi, los cuales están estrechamente relacionados con Toxoplasma gondii y pueden reaccionar serológicamente en forma cruzada (Nishikawa et al., 2002). El uso de antígenos organismo-específicos generados por clonación molecular y el uso de anticuerpos específicos, podrían dilucidar la especificidad y el tiempo de la infección. Los títulos crecientes o elevados de anticuerpos en el perro pueden apoyar un diagnóstico de meningoencefalitis por Toxoplasmosis, Blastomicosis o Distemper.
Se ha desarrollado una técnica de PCR en perros y gatos muy sensible en distintos fluidos, incluido el humor acuoso (Piergili, 2004).
El diagnóstico de la toxoplasmosis clínica en los gatos y perros se basa, también, en la detección de taquizoítos en el examen citológico de aspirados traqueales, o de fluidos por lavado broncoalveolar y de la efusión pleural (Dubey JP, 2003).
Asimismo, en los casos de toxoplasmosis digestiva en los gatos, es necesaria la búsqueda de taquizoítos en el fluido abdominal, y descartar la infección por FIP a través de técnicas inmunohistoquímicas en órganos biopsiados. Actualmente, es común la búsqueda de la presencia de Toxoplasma gondii por microscopía directa y tinción inmunohistoquímica con suero anti-Toxoplasma gondii en distintos órganos y ganglio, etc. de material obtenido por biopsia o de una necropsia (Dubey & Carpenter, 1993). La polimiositis toxoplásmica en caninos se diagnostica por biopsia muscular y seroconversión positiva (Greene et al., 1985).
La toxoplasmosis ocular, a pesar del mejoramiento de las pruebas diagnósticas que incluyen la determinación de anticuerpos IgM y el PCR, sigue siendo un desafío.
Los estudios complementarios por imágenes (radiología, tomografía computada, resonancia magnética, ecografía, electroretinografía y angiografía fluoresceínica) son importantes para el diagnóstico y el grado de evolución de las patologías que afectan los ojos y el SNC en estas especies domésticas, si bien requieren instrumentación especializada, son poco empleadas en la clínica veterinaria. En general, la radiología no contribuye a confirmar el diagnóstico de toxoplasmosis en perros, pero en cambio, en los gatos con pulmones comprometidos, la radiografía puede revelar numerosas áreas irregulares de densidad heterogénea.
Los gatos con convulsiones, deben ser estudiados y buscar en el SNC las imágenes características en la resonancia magnética que sugieren la presencia de granulomas cerebrales. Si la serología indica una toxoplasmosis activa y la excisión quirúrgica del granuloma es posible, se realiza un diagnóstico diferencial definitivo con exámenes inmunohistoquímicos (Pfohl & Dewey, 2005).
El examen del líquido cerebro espinal en perros con toxoplasmosis, muestra un predominio de las células mononucleadas, principalmente linfocitos. Otros signos, como la gravedad específica o un aumento de la presión del líquido (>180 mm/agua en el perro) pueden deberse a cualquier tipo de desorden cerebral.
El examen hematológico revela sólo eosinofilia en el perro infectado con parásitos que afectan el SNC, como la larva migrans visceral o toxoplasmosis.
A los efectos epidemiológicos, la genotipificación de las cepas de Toxoplasma gondii aislados en animales infectados, mediante el estudio por restricción enzimática (RFLP) del gene SAG-2 es de creciente importancia (Da Silva et al., 2005).
Tratamiento de la Toxoplasmosis en Perros y Gatos:
La clindamicina, antibiótico del grupo de las lincosamidas, es la droga de elección para la toxoplasmosis clínica del perro (10-20 mg/kg/PV/12 h, durante 2 semanas) y en el gato (12,5-25 mg/kg/PV/12 h, durante 2 semanas) por vía parenteral u oral, aunque suelen producirse casos de intolerancia por esta última vía (Barrs et al., 2006, Botana et al., 2002). El tratamiento agresivo con clindamicina, que actuaría inhibiendo la peptidiltransferasa, coincide con la disminución de los títulos anti-Toxoplasma en el gato.
La sulfadiazina, a la dosis de 30 mg/kg y la pirimetamina a 0,4 mg/kg combinadas son muy eficaces en ambas especies. Se administran por la vía oral, cada 12 horas durante 14 días, pero están contraindicadas en los animales gestantes en la etapa de la embriogénesis por los efectos teratogénicos (Botana et al., 2002). La pirimetamina puede desarrollar supresión de la médula ósea, por lo tanto se recomienda la administración preventiva de ácido fólico, por el tiempo que se administre pirimetamina. En los gestantes, en cambio, la droga de elección es la espiramicina.
En gatos, también hay un tratamiento para evitar la excreción de ooquistes con drogas anticoccidiósicas (toltrazuril, monensina, sulfamidas).
Se debe considerar, siempre, el estado serológico para toxoplasmosis de los gatos antes del uso de drogas que son poderosas inhibidoras de la inmunidad mediada por células, como el caso de la ciclosporina (Barrs et al.,et al., 1985, Davidson, 2000). 2006). Este no-decapéptido cíclico ha mostrado promisorios resultados como agente inmunosupresor en los tratamientos del gato contra los granulomas eosinofílicos, el prurito alérgico-facial, la atopía felina y otras dermatosis cutáneas. Sin embargo, la inhibición de la función de los linfocitos-T predispone al desarrollo de una toxoplasmosis sistémica. Asimismo0, los prolongados tratamientos con glucocorticoides en caninos con problemas de piel, pueden desencadenar una polimiositis toxoplásmica, la que ha remitido con la administración de clindamicina (Greene
La resolución de los casos de miocarditis toxoplásmica en los gatos se logra con el tratamiento tradicional. En aquellos felinos con granulomas encefálicos por Toxoplasma gondii, se procede a la resección quirúrgica y al tratamiento con fenobarbital por las convulsiones y con clindamicina como antiparasitario durante un mes (Pfohl & Dewey, 2005).
Profilaxis ambiental de la Toxoplasmosis en Perros y Gatos:
La prevención de la toxoplasmosis proveniente de gatos domésticos debería centralizarse en la higiene de los cajones de las deposiciones, con limpieza diaria y fuera de las cocinas o comedores. La limpieza no debe ser efectuada por personas inmunodeprimidas o mujeres embarazadas, pero en caso contrario, es imperativo el uso de guantes durante la tarea y el inmediato lavado de manos posteriormente a ella. El contacto directo con los gatos raramente puede resultar en la transmisión de la infección, porque la mayoría de los gatos no dejan materia fecal en pelo en esos primeros cinco días requeridos para la esporulación de los ooquistes. En cambio, sí debe impedirse que los gatos cacen y coman carne cruda o mal cocida. Asimismo, la alimentación del perro con órganos crudos de ovinos está considerada como una de las fuentes más comunes de infección en esta especie. Debido a que los gatos mantenidos afuera de las casas defecan en los jardines y los ooquistes toxoplásmicos pueden sobrevivir durante meses bajo condiciones apropiadas, es indispensable que las personas inmunodeprimidas usen guantes al hacer la jardinería o cuando trabajen con la tierra, además del consiguiente lavado de manos.
Las mujeres embarazadas deben observar particular higiene en su relación con los gatos, ya que éstos pueden contagiarlas. El médico veterinario es fuente de consulta sobre las medidas de prevención primaria que debe tener la mujer embarazada susceptible.
En las recomendaciones se insistirá en:
La mujer embarazada es susceptible a la infección cuando no tiene anticuerpos anti-Toxoplasma gondii. Es un dato que toda mujer embarazada debe conocer.
El lavado frecuente de las manos antes de alimentarse.
El lavado de manos después de manipular carne cruda o vegetales frescos.
Ingestión de carne bien cocida, ahumada o en salmuera.
La limpieza de las superficies de la cocina que estuvo en contacto con carne cruda o vegetales frescos.
Alimentarse con vegetales frescos sólo cuando se sepa que fueron bien lavados.
El trabajo de jardinería siempre con guantes y el lavado de manos.
Evitar el contacto directo con excretas de gatos.
En el caso de poseer una mascota felina se recomienda remover las excretas diariamente, con guantes y lavado de las manos. La explicación está dada porque los ooquistes son infectantes a partir de las 36 horas de su eliminación.
En los pequeños carnívoros domésticos aún no se han desarrollado vacunas, como sí en las ratas, ovejas o cerdos inmunizados con quistes o taquizoítos de la cepa RH o la S48 de Toxoplasma gondii, con el agregado de inmunoestimuladores (Kringel et al., 2004; Freyre et al., 2006).
Se recomienda enfáticamente, asimismo, que los caninos y felinos dadores y recipientes en transplantes de riñón, sean serológicamente examinados previamente a la cirugía, ya que la toxoplasmosis puede ser una fatal complicación en los receptores de transplante renal debido a los tratamientos con inmunodepresores (Bernsteen et al., 1999). Los dadores reactores seropositivos no deben ser usados en recipientes seronegativos, y éstos, a su vez, deben ser examinados de cerca por la presencia de signos clínicos de toxoplasmosis después de la cirugía.
Agradecemos al colaboracion para la publicacion de este articuloa: Ricardo Durlach, Pablo Martino. Del Libro Temas de Zoonosis IV. Edit. Asociación Argentina de Zoonosis. Capítulo 42.
Referencias bibliográficas:
1. Barrs VR, P Martin & JA Beatty. Antemortem diagnosis and treatment of toxoplasmosis in two cats on cyclosporin therapy. Aust Vet J. 2006; 84: 30-35.
2. Dubey JP, JL Carpenter. Histologically confirmed clinical toxoplasmosis in cats: 100 cases (1952-1990). JAVMA. 1993; 203: 1556-1566.
3. Dubey JP, IT Navarro, C Skreekumar et al. Toxoplasma gondii infections in cats from Paraná, Brazil: seroprevalence, tissue distribution and biologic and genetic characterization of isolates. J Parasitol. 2004; 90: 721-726.
4. Dubey JP, MC Venturini, L Venturini et al. Isolation and genotyping of Toxoplasma gondii from free-ranging chickens from Argentina. J Parasitol. 2003; 85: 1063-1064.
5. Dubey JP, A Zajac, SA Osofky et al. Acute primary toxoplasmic hepatitis in an adult cat shedding Toxoplama gondii oocysts. JAVMA. 1990; 197: 1616-1618.
6. Durlach R. Epidemiología de las infecciones por Toxoplasma gondii. En: Temas de Zoonosis II. Cap: 43. Cacchionne R, Durlach R, Larghi OP. (Eds). Editorial Ideográfica, Buenos Aires, 2004; 320-327.
7. Durlach R, F Kaufer, L Carral et al. Toxoplasmic Lymphadenitis-Clinical and Serologic Profile. Clin Microbiol Infect. 2003; 9: 625-631.
8. Gury Dohmen FE. Toxoplasmosis en perros y gatos de Buenos Aires. Rev Med Vet. 1995; 76: 65-68.
9. Hirt J. Toxoplasmosis congénita. Cap: 40 En: Temas de Zoonosis II. Cacchionne R, Durlach R, Larghi OP. (Eds). Editorial Ideográfica, Buenos Aires, 2004; 297-304.
10. Martino PE, NO Stanchi & JJ Martino. Estudio serológico por aglutinación directa de toxoplasmosis en animales de peletería y silvestres. Therios, 1988; 12: 411-416.
11. Venturini MC & L Venturini. La Toxoplasmosis en Medicina Veterinaria. En: Temas de Zoonosis II. Cap: 41. Cacchinne R, Durlach R, Larghi OP. (Eds). Editorial Ideográfica. Buenos Aires. 2004; pp. 305-311.
Recomendar
a un amigo...
 Mascotas Foyel Cuidados para toda clase de animales
Mascotas Foyel Cuidados para toda clase de animales 
La toxoplasmosis clínica es comúnmente reportada en gatos, siendo la fiebre persistente, la ictericia terminal, la leucopenia, los desórdenes oculares, pulmonares, hepáticos, neurológicos, gastrointestinales y musculares, los hallazgos más consistentes. Los gatos jóvenes son más susceptibles a la forma aguda de la enfermedad, y observan períodos extendidos de elevadas temperaturas refractarios a la medicación, acompañados de letargia, anorexia y disnea. Los síntomas pueden semejar, ocasionalmente, un distress respiratorio (sin tos) por la progresiva bronconeumonía, una severa enteritis, u ocasionalmente, una miocarditis, pancreatitis, hepatitis o linfoadenitis abdominal (Nelson Couto, 1998). A veces, la toxoplasmosis digestiva en los gatos ascíticos está asociada a la Peritonitis Infecciosa Felina (PIF) (Toomey et al., 1995). En nuestro medio, se han observado los síntomas neurológicos y oculares, como los más frecuentes entre gatos y perros examinados en la clínica diaria (Gury Dohmen, 1995). La miocarditis es frecuentemente identificada en el examen post-mortem, aunque puede ser detectada clínicamente por ecocardiografía acompañada de un aumento en los títulos IgG e IgM anti-Toxoplasma. Se han observado abortos en gatas y, si la infección es sistémica, puede ser confundida con la Panleucopenia Felina o, simplemente, con una obstrucción intestinal, estando los síntomas en función del órgano afectado. En caso de un compromiso masivo, la muerte puede ocurrir en pocos días. Los síntomas de toxoplasmosis congénita corresponden a los daños infringidos por el parásito durante el desarrollo fetal. Incluyen hidrocefalia o microcefalia, calcificaciones intracraniales, sordera, convulsiones, parálisis muscular, daño retinal y retardo mental, la mayoría desarrollados en distintos momentos del crecimiento. También puede alterar el comportamiento y la función neurotransmisora. Sin embargo, los síntomas nerviosos en el gato no son comunes, incluso en aquellos individuos con la infección cerebral, y se resumen en ataxia, pérdida de la visión, incoordinación, temblores, agitación de cabeza y desplazamientos en círculo (Fulley Torrey & Yolken, 2003). Los gatos mayores de edad son propensos a formas crónicas, con síntomas semejantes a los de un linfosarcoma, acompañados de síntomas nerviosos como las convulsiones, debido a los granulomas toxoplásmicos en el cerebro (Pfohl & Dewey, 2005). Toxoplasma gondii ha demostrado ser causante de la pérdida de memoria y retardar el aprendizaje en ratones y ratas (Freyre A et al., 2006). Estos cambios de comportamiento conducen a los roedores a la disminución de su aversión por el olor a los gatos y aumentan la probabilidad de que sean cazados y comidos por estos últimos. Esto permite al Toxoplasma gondii completar su ciclo vital: todo un ejemplo de “manipulación evolutiva del hospedador” por el parásito (Berdoy et al., 2000).
La IFAT establece convencionalmente la prevalencia de anticuerpos anti-Toxoplasma gondii IgG específicos en suero y humor acuoso de gatos, con un título mínimo positivo de 1:32 (Haddadzadeh et al., 2006; Meunier et al., 2006). La detección de IgG específicas también se realiza mediante aglutinación directa o HAI. Las IgG se elevan a las 2 a 4 semanas de la infección y persisten al menos por un año. No obstante, un solo titulo positivo de IgG no permite distinguir la infección activa de la crónica. Es necesario realizar, al menos, 2 determinaciones séricas de IgG en el término de 2 a 3 semanas. En caso que los títulos se eleven hasta 4 veces, se trataría de una infección activa. A veces, estos gatos muestran títulos de suero anti-Toxoplasma gondiiet al., 2005). mayores o iguales a 1:1204. Los títulos de los anticuerpos caen prácticamente a nivel mínimo al tiempo que la infección se hace crónica (6-10 meses post-infección). La seroprevalencia en los gatos, aumenta con la edad y es mayor en machos y en gatos domésticos de pelo corto, en comparación con las hembras y otras razas, según recientes estudios epidemiológicos en búsqueda de anticuerpos específicos IgG e IgM con la prueba de ELISA, que arrojó hasta un 43% de seropositividad con al menos una de las gammaglobulinas (Vollaire


 contáctenos
contáctenos


