Mascotas Foyel Cuidados para toda clase de animales
Mascotas Foyel Cuidados para toda clase de animales Que es la Inmunooncologia Veterinaria - Dr. Guillermo Hermo
El cáncer es una enfermedad compleja y dinámica, cuya evolución está muy influenciada por el medio y el microambiente en los que se desarrolla la célula neoplásica. Son de gran importancia las interacciones de la célula tumoral con células endoteliales, fibroblastos, vasos sanguíneos, vasos linfáticos, células inmunitarias, citosinas y productos del metabolismo celular. La complejidad inherente de esta enfermedad multifactorial hace que continuamente se esté buscando nuevas alternativas terapéuticas más efectivas a las ya conocidas.
Para mejorar la supervivencia y la calidad de vida de nuestros pacientes con cáncer son necesarias nuevas estrategias terapéuticas, y en este sentido, la inmunooncología está revolucionando el abordaje de este conjunto de enfermedades. Hay estudios recientes que han esclarecido y consolidado su potencial, de forma que hoy ya no podemos contemplar la oncología sin la inmunoterapia.
Aunque ha sido un tema muy debatido en la historia de la Inmunología, en estos momentos se admite que existe una respuesta inmunitaria contra el cáncer, que es iniciada por señales de peligro producidas por el desarrollo tumoral y completada por células efectoras, como las células natural Killer (NK) y los linfocitos T citotóxicos (CTL). De lo que no cabe duda es que pueden explotarse los mecanismos inmunitarios para luchar contra el cáncer, y la inmunoterapia antitumoral es ya una realidad en la clínica.
Inmunoterapia antitumoral: un poco de historiaProbablemente haya otros antecedentes en la medicina clásica, pero suele aceptarse que el primer estudio en que se plantea la activación del sistema inmunitario para luchar contra el cáncer es el que realizó William Coley en 1891. Basándose tanto en sus propias observaciones como en las de Koch, Pasteur y Von Behring de que algunos pacientes de cáncer mejoraban tras episodios de fiebre alta debida a una infección por Streptococcus pyogenes, Coley inyectó bacterias de esta especie directamente en el tumor de un paciente con sarcoma varias veces durante 1 año; el tumor regresó, y el paciente sobrevivió 8 años más. Más tarde mejoró su «cóctel» bacteriano, generó la llamada “toxina de Coley” y siguió experimentando durante unos años. Los resultados fueron variables, con algunos efectos secundarios indeseables, y finalmente, con la irrupción de nuevas opciones terapéuticas antitumorales como protocolos de radioterapia y quimioterapia, esta práctica se abandonó.
Paul Ehrlich sugirió por primera vez, en 1909, la existencia de una «vigilancia inmunitaria» contra el desarrollo tumoral. Sin embargo, no fue hasta 1970 que MacFarlane Burnet propuso la teoría de la vigilancia antitumoral por parte del sistema inmunitario con una cierta base molecular y celular.
A pesar de hallar evidencia de que la inmunidad antitumoral puede ser transferida por los linfocitos T entre ratones singénicos, la teoría de la vigilancia antitumoral cayó en el olvido tras demostrarse que ratones «nude», carentes de linfocitos T o B, eran igual de susceptibles al desarrollo de tumores inducidos por carcinógenos y al desarrollo de tumores espontáneos que los ratones normales de la misma estirpe. Es interesante destacar que estos ratones inmunodeficientes no tienen afectada la inmunidad innata y que, en concreto, poseen células NK (natural killer, descritas por Ronald Herberman en 1976). Este hecho no fue beneficioso para el desarrollo de inmunoterapias antitumorales, aunque por la misma época se barajaba el concepto de la “bala mágica”, basado en la posible utilización de anticuerpos que fueran específicos contra antígenos tumorales.
Sin embargo, no fue hasta finales del siglo pasado, tras la demostración de que los ratones deficientes en perforina o en interferón gamma o en sus receptores, eran claramente más propensos al desarrollo del cáncer, con lo cual la teoría de la vigilancia inmunitaria volvió a cobrar fuerza.
Aunque este ha sido un tema muy debatido en la historia de la inmunología, en estos momentos se admite que existe una respuesta inmunitaria contra el cáncer, que es iniciada por señales de peligro producidas por el desarrollo tumoral. Estas señales atraen y activan a células del sistema inmunitario innato. Tales fenómenos producen la maduración de células presentadoras de antígeno, lo que culmina con la generación de una respuesta adaptativa específica mediada por linfocitos T CD4+ y sobre todo CD8+. No obstante, esta misma respuesta inmunitaria “moldea” al tumor, de modo que pueden seleccionarse en algunos casos variantes tumorales que son resistentes a los mecanismos efectores del sistema inmunitario o que generan tolerancia, en un proceso conocido como inmunoedición o immunoediting. Esta teoría predecía que los tumores pueden permanecer en un estado latente en equilibrio con el sistema inmunitario durante mucho tiempo, y que si este estado de equilibrio era superado por el tumor, se produciría la enfermedad. La predicción fue confirmada experimentalmente, al demostrarse que tanto los linfocitos T CD4+ como los CD8+ estaban implicados en dicho estado de equilibrio.
Consultas con Dr. Guillermo Hermo »
Objetivos en la lucha contra el cáncer en veterinariaLa mayoría de los tratamientos antitumorales actuales pretenden superar dos de las principales características del cáncer: la excesiva proliferación y la resistencia a la apoptosis.
La apoptosis puede inducirse por dos vías principales: intrínseca (en la que la mitocondria desempeña un papel esencial) y extrínseca (activada tras la unión de los ligandos mortales a sus correspondientes receptores mortales en la célula tumoral). Una de las principales moléculas encargadas de detectar el daño celular y activar la vía intrínseca de la apoptosis es el gen de supresión tumoral p53. Muchos de los tratamientos quimioterapicos convencionales inducen daño en el DNA activando la vía intrínseca de la apoptosis de una manera dependiente de p53. Sin embargo, la inactivación funcional de p53 es una de las características genéticas más comunes en el cáncer y contribuye a la resistencia que presentan las células tumorales a la muerte celular inducida por la vía intrínseca inducida por drogas quimioterápicas. Por ello, las terapias antitumorales basadas en el empleo de ligandos mortales que inducen la apoptosis de las células tumorales a través de la vía extrínseca, en la que la contribución de p53 es prescindible, pueden ser una alternativa atractiva.
Los mecanismos más importantes por los que estos linfocitos llevan a cabo dicha función son la inducción de la apoptosis a través de la vía extrínseca gracias a la expresión y la secreción de ligandos mortales (Fas ligando –FasL–, Apo2 ligando/TRAIL –Apo2L/TRAIL–), y la vía de la exocitosis granular. En esta última, la perforina permite a la granzima B y a la granulisina acceder al interior celular para ejercer la muerte apoptótica.
El escape tumoral a la acción de la inmunovigilancia puede favorecerse gracias a la inducción de una plétora de mecanismos inmunosupresores que comprenden la secreción de citocinas específicas y la presencia de células inmunorreguladoras en el microambiente tumoral.
En la actualidad se están desarrollando diferentes estrategias de inmunoterapia dirigidas a revertir este estado de inmunosupresión y a recuperar la activación y las funciones de los efectores linfocitarios.
Otro aspecto que afecta a la eficacia de los tratamientos antitumorales, incluida la inmunoterapia, es el microambiente tumoral, que suele ser inmunosupresor y favorece la tolerancia inmunitaria con respecto al tumor. Sería muy conveniente, en consecuencia, establecer tratamientos que pudieran revertir esta situación ventajosa para los tumores, y combinarlos con inmunoterapias.
Inicio del escape tumoral: alteraciones en la expresión de moléculas del Complejo Mayor de Histocompatibilidad de tipo I (CMH-I)
Se conoce desde hace tiempo que la transformación maligna de las células se asocia a una alteración en la expresión y/o la función de las moléculas del CMH-I. De hecho, los defectos en la expresión de moléculas del CMH-I se han observado en una gran variedad de neoplasias malignas. Las anomalías en las moléculas del CMH-I proporcionan a las células neoplásicas la capacidad para escapar del reconocimiento por parte del sistema inmunitario adaptativo.
Los mecanismos moleculares implicados en las alteraciones de la expresión de moléculas del CMH-I en la célula tumoral pueden ser genéticos (de gen o de cromosoma) o reguladores (en la transcripción). Cuando la alteración molecular que produce los cambios en la expresión del CMH-I puede corregirse mediante la acción de citocinas (defectos soft o reguladores), la expresión del CMH-I aumenta y, en consecuencia, también la respuesta antitumoral de las células T. En cambio, si el defecto molecular es estructural (lesión hard) resulta irreversible, por lo que la expresión HLA continúa baja y termina prevaleciendo el escape tumoral.
En diferentes tumores humanos se ha descrito un descenso de moléculas coestimuladoras de la familia B7 que resulta en un proceso de anergia de células T40, una disminución de la expresión de la cadena CD3ζ del TCR que impide una activación óptima de la célula T41, y una pérdida selectiva de ligandos activadores y de receptores NK, como NKG2D, NKp30, y NKp4615.
En células tumorales se ha observado la adquisición de cambios genéticos o epigenéticos que incrementan la resistencia a la apoptosis mediada por receptores de muerte, y que suele producirse por la modulación de factores proapoptóticos y anti-apoptóticos (p. ej., aumento de Bcl-2), y el descenso o la pérdida de la expresión de receptores Fas o TRAIL40.
Recientemente ha cobrado especial importancia el aumento de la expresión tumoral del ligando del receptor de muerte programada (PD-L1), cuya interacción con el receptor PD-1 en la superficie linfocitaria afecta a la supervivencia y a la función de los efectores inmunitarios.
Factores derivados del tumor (FDT): Los FDT pueden favorecer el escape tumoral suprimiendo la inmunidad innata y adaptativa. Los más importantes son el factor de crecimiento vascular endotelial (VEGF, vascular endothelial growth factor), la IL-10, las ROS, la indolamina-2,3-dioxigenasa (IDO), las prostaglandinas (p. ej., PGE2) y el TGF-β.”
El TGF-β desempeña un papel destacado en el escape tumoral al suprimir la diferenciación, la proliferación y la función efectora de las células T.
Cánceres más inmunogénicos (humana): Melanomas, Colorrectal, Mama , Cabeza y cuello, Vejiga, Ovario, Esófago, Pancreático, Pulmón, Próstata (*) En medicina veterinaria las mayores experiencias y datos están en melanomas.
Tratamientos posibles del cancer:
Son muchos los tratamientos inmunoterapéuticos posibles. Muchos de ellos en estado de investigación /optimización.
Nombrando los más relevantes podemos decir:1 - Recombinante soluble de Apo2L/TRAIL1
2 - Anticuerpos monoclonales dirigidos contra los receptores proapoptóticos de Apo2L/TRAIL, DR4 y DR5
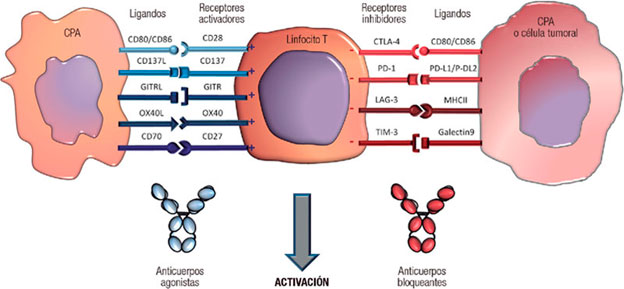
3 - Anticuerpos inhibidores anti-CTLA-4 y anti-PD-1: Estos anticuerpos contribuyen a desbloquear señales inhibidoras existentes entre la célula tumoral u otras células del infiltrado y los linfocitos T citotóxicos.
4 - Anticuerpos monoclonales agonistas, estimulando la activación de linfocitos T, tales como anticuerpos dirigidos hacia CD28, CD 137, GITR, OX40 y CD 27.
5 - Anticuerpo conjugado con toxinas. Por ejemplo, las auristatinas y los maitansinoides son moléculas quimioterápicas que pueden ser entre 100 y 1.000 veces más potentes que los taxanos y los derivados de la vinca, pero su toxicidad impide su administración sistémica. Sin embargo, la conjugación química de estos agentes con un AcMo puede ser posible limitando la toxicidad sistémica y aumento el efecto citotóxico local y especifico.
6 - Granzima B
7 - Terapias dirigidas a aumentar la expresión de MHC-1 (que suele estar no expresado o muy bajamente expresado en las metástasis).
8 - Inhibición de T reg (por ejemplo con Sunitinb)
9 - Vacunas de antígenos mutados: neoantígenos derivados de la acumulación de mutaciones que afectan a múltiples genes en las células tumorales.
10 - Vacunas de antígenos virales: péptidos antigénicos codificados por genes virales expresados en tumores humanos con origen viral.
11 - Vacunas de antígenos compartidos: codificados por genes silenciosos presentes en tejidos adultos, pero expresados en tumores de distinto tipo histológico.
12 - Vacunas de antígenos específicos: expresados por el tumor y a menudo también por el tejido normal a partir del cual se desarrolla, llamándose antígenos asociados a tumor.”
13 - Citoquinas: interleucina (IL) 2
14 - Interferón: interferón alfa (IFN-α)
15 -Transfección un gen sano de moléculas del CMH-I funcional a las células tumorales
16 - IDO Inhibidores (epacadostat, indoximod, 1-methyltryptophan, Navoximod)
17 - Inmunoterapia antitumoral adoptiva con linfocitos T y células naturales Killer (NK)
18 - Terapia génica con “gen suicida”
Consultas con Dr. Guillermo Hermo »
Monitorización y seguimiento de la respuesta antitumoral
Es sumamente importante llegar a definir marcadores predictivos y de pronóstico. Hoy por hoy no se dispone de este tipo de biomarcadores, si bien los mejores correlatos se encuentran con el infiltrado linfocitario en las biopsias tumorales pretratamiento.
Al contrario que la quimioterapia, la inmunoterapia se basa en las acciones antineoplásicas indirectas a través del sistema inmunitario del paciente; Esto significa que las respuestas pueden diferir de aquellas que se producen con los tratamientos antineoplásicos más tradicionales en lo que se refiere a los ritmos, la duración y a cómo se manifiestan. Este efecto indirecto puede hacer que se vea un retraso en la aparición de la respuesta. Por otra parte, la progresiva infiltración linfocitaria puede dar lugar a un aumento del tamaño de la lesión. Para ello ha sido necesario crear unos nuevos criterios de respuesta para las inmunoterapias.
Por ejemplo, las respuestas a la inmunoterapia pueden ocurrir después de la progresión convencional, la estabilización prolongada de la enfermedad puede representar un parámetro de actividad antitumoral, por lo que deben permitirse progresiones “clínicamente no significativas” con este tipo de terapias. Se recomienda interiorizarse en las guías para la evaluación de inmunoterapias en tumores sólidos.
¿Que hay en medicina veterinaria?En medicina veterinaria hay publicaciones científicas de vacunas con Corynebacterium Parvum, Bacilum Calmette-Guerin (BCG), Salmonella Typhimurium, súper antígenos bacterianos, muramyl tripeptide, administración de IL-2, IL-6, IL-15 en diferentes esquemas terapéuticos, INF alfa, INF omega, INF gamma, vacunas con ADN xenogénico, células dendríticas.
Sin embargo al ser el sistema inmune tan complejo con tan variados tipos y estadios clínicos tratados, es muy difícil obtener datos objetivos. Los mejores resultados en inmunoterapia parecerían verse en los melanomas caninos.
La vacuna veterinaria contra melanoma ONCEPT®, es una vacuna de DNA recombinante que se recomienda para los melanomas orales en estadio II y III en adyuvancia, en donde la enfermedad local ha sido controlada; o sea, con una cirugía de por medio del tumor primario y con linfonodos regionales negativos, linfonodos regionales positivos y extirpados o irradiados.
Fue aprobada por FDA porque el estudio respaldatorio con 11 animales logro aumentar significativamente la sobrevida respecto al grupo placebo (o sea, al grupo que no recibió ningún tipo de tratamiento oncológico). Sin embargo las sobrevidas en melanoma en estadio II y III suelen ser mayores cuando se utiliza el régimen de cirugía y quimioterapia.
Es muy importante resaltar el screening de los linfonodos regionales en melanomas, ya que cuenta con una alta tasa de positividad y muy frecuentemente son pasados por alto por los veterinarios.
En caninos se han desarrollado y aun se continúan evaluando su efectividad clínica anticuerpos monoclonales anti-CD20 para linfoma de células B, anti-EGFR en cáncer de vejiga, anti PD-L1 en melanomas, anti CD138 en linfomas de células B y carcinomas mamarios.
ConclusiónEstos resultados prometedores en pacientes con cáncer en estadios avanzados indican una vez más que los linfocitos T tienen una importante función en la destrucción de células tumorales, incluso en fase metastásica. Queda aún un largo camino por recorrer debido a la complejidad de los mecanismos de escape y de inhibición descritos hasta la fecha, pero no hay duda de que estamos viviendo una nueva etapa de innovación terapéutica, en la cual la inmunoterapia del cáncer ocupa y ocupará un lugar muy relevante.
La terapia con vacunas antitumorales sería una muy buena opción en pacientes con estadios menos avanzados y administradas en adyuvancia. Es importante la realización de estudios aleatorizados, unicéntricos o multicéntricos, para demostrar la eficacia clínica.
Por último, el diseño de terapias combinadas con un efecto sinérgico en el bloqueo de las señales que sean inhibidoras del tumor, y la potenciación de la respuesta específica de antígeno, ofrecen una perspectiva terapéutica real para los pacientes con cáncer, minimizando los efectos secundarios derivados de la quimioterapia sistémica.
La inmunooncología probablemente produzca un gran cambio en los tratamientos oncológicos y en la lucha contra el cáncer; sin embargo eso ira fuertemente ligada a la previa tipificación del estado inmunitario del paciente, como de determinadas características inmunológicas del propio cáncer.
Es fundamental que los proyectos de investigación de inmunooncología vayan avanzando en forma coordinada tanto con los grupos de investigación en nuevos tratamientos como en diagnóstico y tipificación / estadificación.
Agradecemos la colaboración para la publicación de este artículos al Dr. Guillermo A. Hermo - Médico Veterinario – Doctor en Ciencias Veterinarias. Especialista en Clínica de Caninos y Felinos Domésticos, con orientación en Oncología (CVPBA). MP 9.418 - Laboratorio Farmacéutico Veterinario CHEMOVET - 9 de Julio 3875 - Lanús Este. Buenos Aires. Argentina. TE: +54 (011) 4220 - 3594 // + 54 (011) 15 – 6665 - 7836 - www.chemovet.org - Consultas con Dr. Guillermo Hermo »
BibliografiaBergman PJ, Camps-Palau MA, McKnight JA, et al: Development of a xenogeneic DNA vaccine program for canine malignant melanoma at the Animal Medical Center, Vaccine 24:4582–4585, 2006.
Bergman PJ, et al. Development of a xenogeneic DNA vaccine program for canine malignant melanoma at the Animal Medical Center. Vaccine 2006;24:4582-4585.
Bergman PJ, et al. Long-Term Survival of Dogs with Advanced Malignant Melanoma after DNA Vaccination with Xenogeneic Human Tyrosinase: A Phase I Trial. Clinical Cancer Research 2003;9:1284-1290.
Chou PC, Chuang TF, Jan TR, et al: Effects of immunotherapy of IL-6 and IL-15 plasmids on transmissible venereal tumor in beagles, Vet Immunol Immunopathol 130:25–34, 2009.
Diab M, Nguyen F, Berthaud M, Maurel C, Gaschet J, Verger E, Ibisch C, Rousseau C, Chérel M, Abadie J, Davodeau F. Production and characterization of monoclonal antibodies specific for canine CD138 (syndecan-1) for nuclear medicine preclinical trials on spontaneous tumours. Vet Comp Oncol. 2017 15(3):932-951.
Dunn GP, Bruce AT, Ikeda H, et al: Cancer immunoediting: from immunosurveillance to tumor escape, Nat Immunol 3:991–998, 2002.
Finocchiaro LM1, Fiszman GL, Karara AL, Glikin GC. Suicide gene and cytokines combined nonviral gene therapy for spontaneous canine melanoma. Cancer Gene Ther. 2008.
Funk J, Schmitz G, Failing K, et al: Natural killer (NK) and lymphokine-activated killer (LAK) cell functions from healthy dogs and 29 dogs with a variety of spontaneous neoplasms, Cancer Immunol Immunother 54:87–92, 2005.
Helfand SC, Soergel SA, MacWilliams PS, et al: Clinical and immunological effects of human recombinant interleukin-2 given by repetitive weekly infusion to normal dogs, Cancer Immunol Immunother 39:84–92, 1994.
Joyce JA, Pollard JW: Microenvironmental regulation of metastasis, Nat Rev Cancer 9:239–252, 2009.
Jain S, Aresu L, Comazzi S, Shi J, Worrall E, Clayton J, Humphries W, Hemmington S, Davis P, Murray E, Limeneh AA, Ball K, Ruckova E, Muller P, Vojtesek B, Fahraeus R, Argyle D, Hupp TR. The Development of a Recombinant scFv Monoclonal Antibody Targeting Canine CD20 for Use in Comparative Medicine. PLoS One. 2016.
Juan Otero y Sirera Pérez. Inmunoterapia del cáncer. Realidades y perspectivas: Sociedad Española de Inmunología. 2015.
Khanna C, Anderson PM, Hasz DE, et al: Interleukin-2 liposome inhalation therapy is safe and effective for dogs with spontaneous pulmonary metastases, Cancer 79:1409–1421, 1997.
Kurzman ID, MacEwen EG, Rosenthal RC, et al: Adjuvant therapy for osteosarcoma in dogs: results of randomized clinical trials using combined liposome-encapsulated muramyl tripeptide and cisplatin, Clin Cancer Res 1:1595–1601, 1995.
Liao JCF, et al. Vaccination with human tyrosinase DNA induces antibody responses in dogs with advanced melanoma. Cancer Immunity 2006;6:8-17.
Liu MA: DNA vaccines: an historical perspective and view to the future, Immunol Rev 239:62–84, 2011.
Maekawa N, Konnai S, Takagi S, Kagawa Y, Okagawa T, Nishimori A, Ikebuchi R, Izumi Y, Deguchi T, Nakajima C, Kato Y, Yamamoto K, Uemura H, Suzuki Y, Murata S, Ohashi K. A canine chimeric monoclonal antibody targeting PD-L1 and its clinical efficacy in canine oral malignant melanoma or undifferentiated sarcoma. Sci Rep. 2017.
Nagaya T, Okuyama S, Ogata F, Maruoka Y, Knapp DW, Karagiannis SN, Fazekas-Singer J, Choyke PL, LeBlanc AK, Jensen-Jarolim E, Kobayashi H. Near infrared photoimmunotherapy targeting bladder cancer with a canine anti-epidermal growth factor receptor (EGFR) antibody. Oncotarget. 2018
O’Neill K, Guth A, Biller B, et al: Changes in regulatory T cells in dogs with cancer and associations with tumor type, J Vet Intern Med 23:875–881, 2009.
Sinha P, Clements VK, Bunt SK, et al: Cross-talk between myeloid- derived suppressor cells and macrophages subverts tumor immunity toward a type 2 response, J Immunol 179:977–983, 2007.
Thamm DH, Kurzman ID, King I, et al: Systemic administration of an attenuated, tumor-targeting Salmonella typhimurium to dogs with spontaneous neoplasia: phase I evaluation, Clin Cancer Res 11:4827–4834, 2005.
Thamm DH, Kurzman ID, Macewen EG, et al: Intralesional lipid-complexed cytokine/superantigen immunogene therapy for spontaneous canine tumors, Cancer Immunol Immunother 52:473–480, 2003.
Turk MJ, Guevara-Patino JA, Rizzuto GA, et al: Concomitant tumor immunity to a poorly immunogenic melanoma is prevented by regulatory T cells, J Exp Med 200:771–782, 2004.
Wolchok JD, Hoos A, O’Day S, Weber JS, Hamid O, Lebbe C, et al. Guidelines for the evaluation of immune therapy activity in solid tumors: immune-related response criteria. Clin Cancer Res. 2009;15:7412–7420.
Yamaguchi T, Hirota K, Nagahama K, et al: Control of immune responses by antigen-specific regulatory T cells expressing the folate receptor, Immunity 27:145–159, 2007.
Recomendar a un amigo...
A Ud. también le puede interesar estas notas
- La vacunacion de los perros
- Que es una vacuna para perros y gatos
- Uso de la ciclosporina como tratamiento en la alergia de nuestras mascotas
- Porque se enferman ya vacunados los perros y gatos
- Diagnostico del Sindrome de Cushing en caninos
Archivos para descargar
Que es la Inmunooncologia Veterinaria - Dr. Guillermo Hermo - 212.17 KB - (Portable Document Format (.pdf))

 contáctenos
contáctenos- Diseño y desarrollo